リチウムイオン電池の端子電圧は電極電位と過電圧で決まる

- 起電力 = 正極の電極電位 - 負極の電極電位
- 放電時の端子電圧 = 起電力 - 過電圧
- 充電時の端子電圧 = 起電力 + 過電圧
- 端子電圧は理論起電力と過電圧で決まる
端子電圧と起電力、過電圧の関係
リチウムイオン電池の正極と負極の間に発生する端子電圧は起電力と過電圧によって決まります。具体的には以下の式で表されます。
・放電時の端子電圧 = 起電力 - 過電圧
・充電時の端子電圧 = 起電力 + 過電圧
端子電圧は理想的には起電力に等しくなります。しかし現実的な動作では、過電圧と呼ばれるロスを加味する必要があります。
以下で、端子電圧、起電力、過電圧についてと、それらの関係について紹介します。
起電力
起電力は正極と負極の電極電位の差分
起電力は正極と負極の電極電位の差で決まります。
式で書くと以下の通りです。
起電力 = 正極の電極電位- 負極の電極電位 (式1)
電極電位φ0とは、その電極で起こっている反応が平衡状態となる電位です。
平衡状態は右向きと左向きの反応の速度が同じになり、見た目は反応が止まったように見える状況です。
例えば酸化体(反応により電子を受けとるもの)をO、還元体(反応によって電子を受け取ったもの)をRとすると、電極で起こる酸化還元反応は下記のように表せます。
O + ne– ⇔ R (式2)
電子はマイナスの電荷を持つので、電極の電位が高いほど電子のエネルギーは下がります。よって式2の左辺のエネルギが下がり、左向きの反応が進みやすくなります。これにOとRのエネルギを加味して、どの電位で反応が平衡になるのかということです。
起電力の具体例1
例えば正極にコバルト酸リチウムを、負極に金属リチウムを用いた場合を例に考えてみましょう。それぞれの電極で起こる反応は以下のようになります。
正極の反応:Li1-xCoO2 + xLi+ + xe– ⇔ LiCoO2
負極の反応:Li ⇔ Li+ + e–
(右向きが放電反応、左向きが充電反応)
正極の反応の電極電位は0.90 V(vs. SHE)。負極の反応の電極電位は-3.05 V(vs. SHE)です。
参考:名古屋工業大学 川崎研究室サイト
式1を用いるとLiCoO2正極とLi負極セルの理論起電力は以下のように3.95Vとなります。
理論起電力 = 正極の電極電位- 負極の電極電位
= 0.90 - (-3.05) = 3.95 V
起電力の具体例2
負極に黒鉛を用いた場合の負極の反応は以下のようになります。
C6 + xLi+ +xe– ⇔ LixC6、 φ0=-2.90 V(vs. SHE)
式1より、正極にコバルト酸リチウム、負極に黒鉛を用いた場合の起電力は
起電力 = 0.90 - (-2.90) = 3.85 V
となり負極にチリウム金属を用いた場合よりも理論起電力が低くなります。
電位の原点
電位には原点(どこをゼロとするか)には、安定的な反応をする代表的な電極電位の値を用います。
上の段落で説明もなく”vs. SHE”という記載をしましたが、これは「電位の原点(ゼロ点)を標準水素電極電位としている」ことを示しています。標準水素電極をstandard hydrogen electrode (SHE)と呼ぶので、この電位に”対して”ということで”vs. SHE”と書きます。
標準水素電極は、水素イオンと水素ガスの活量が1の電極です。下記の酸化還元反応が平衡状態となっています。
2H+ + 2e– ⇔ H2
標準水素電極は上記の右向きと左向きの反応が可逆的かつ速やかに進むため、電位が安定しており他の電極反応の電位を測定する際の基準となる基準電極(参照電極とも呼ばれる)として用いることができます。
しかし現実的にこの電極を用いるには水素ガスが必要であるなどの煩雑さのため、扱いやすい銀-塩化銀電極などが基準電極として用いられることが多いです。
過電圧
過電圧は、電極電位に対して実際に反応が起こる電位の差のことです。
発生する原因から、活性化過電圧、濃度過電圧、抵抗過電圧の3つに大分されます。
活性化過電圧は、起こしたい反応の活性化エネルギを下げるために必要な損失です。
濃度過電圧は、反応物質が電極付近にスムーズに供給される、もしくは反応後の物質が電極付近から排除されるために必要な損失です。
抵抗過電圧は、電池の部材の抵抗成分によって発生する損失です。
端子電圧と起電力・過電圧の関係
放電時の端子電圧 = 起電力 - 過電圧
充電時の端子電圧 = 起電力 + 過電圧
と書きましたが、なぜ放電時と充電時で過電圧分が足し合わせされるのか、引かれるのかが変わるのかについて以下で説明します。
放電時の端子電圧と起電力・過電圧の関係
たとえば正極にコバルト酸リチウム、負極に黒鉛を用いたリチウムイオン電池における放電反応を考えます。
放電時はコバルト酸リチウムにリチウムイオンがインターカレーション(挿入)する反応が主として起こります。
正極:Li1-xCoO2 + xLi+ + xe– → LiCoO2
負極:LiC6 → C6 + Li+ + e–
放電時における活性化過電圧の影響
右向きの反応がより進むようにするには、原系(左辺)のエネルギを上げる、もしく生成系(右辺)のエネルギを下げることにより、右向きに進む反応の活性化エネルギを左向きの反応よりも小さくする必要があります。
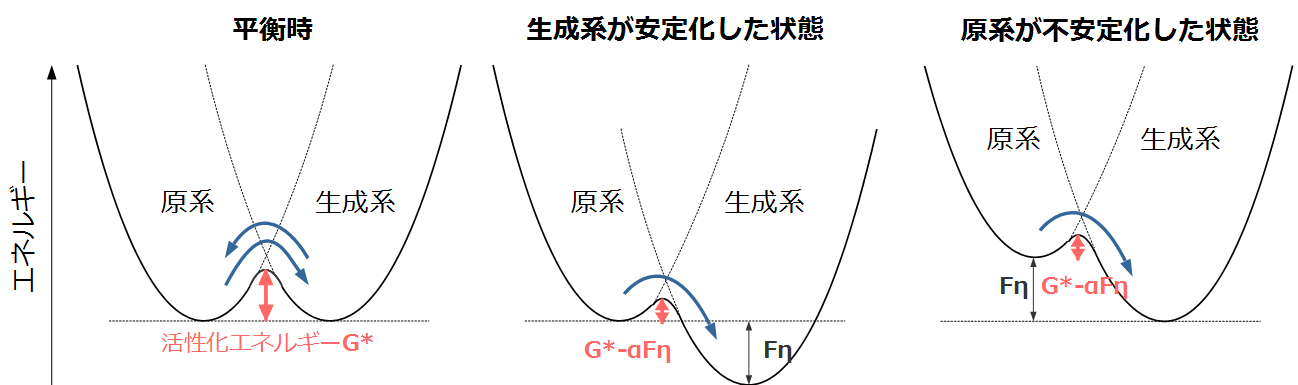
ここでエネルギは電子のエネルギで考えます。正極反応の左辺には電子がありますので、正極の電位を平衡状態の電極電位よりも低くなると、負の電荷の電子のエネルギが増えて、原系(左辺)のエネルギが上がることで右向き反応の活性化エネルギが下がるので、放電電流を取り出せます。
負極反応の右辺にも電子がありますので、負極の電位を平衡状態の電位よりも高くすると、生成系(右辺)のエネルギが下がることで、右向き反応の活性化エネルギが下がるので、電流を取り出せます。
よって活性化過電圧は正極の電位を下げ、負極の電位を上げる方向に働きます。
リチウムイオン電池の端子電圧は正極の電位と負極の電位の差で決まりますので、過電圧ゼロの場合の端子電圧は以下のようになります。
過電圧ゼロの場合の端子電圧 = 正極の理論反応電位 – 負極の理論反応電位
活性化過電圧による正極の反応電位低下分をΔηca(>0)、負極ので電位上昇分をΔηan(>0)とすると、過電圧があるときの端子電圧は以下のようになり、正極と負極の活性化過電圧分だけ小さくなることがわかります。
端子電圧 = 正極の理論電位 – Δηca – (負極の理論電位 – Δηan)
= 過電圧ゼロの場合の端子電圧 – (Δηca + Δηan)
放電時における濃度過電圧の影響
まず正極表面の状態に着目します。反応は正極表面のリチウムイオンが正極にインターカレーション(挿入)する反応ですので、反応が進むと正極表面にある電解液中のLi濃度が下がってきます。すると次第に反応に必要なリチウムイオンが少なくなって反応が進みにくくなります。
反応を進ませるにはLiを速く電極付近に拡散させる必要があります。そこで正極の電位が下がると、プラスの電荷を持つリチウムイオンにとっては正極側がより安定にさせることができます。これにより電極付近へのリチウムイオンの供給を速めることができるの電流を取り出せます。
以上のように、濃度過電圧は正極の反応電位を下げる方向にはたらきます。
負極側も同様に考えます。負極の反応は、負極からリチウムイオンが電解液中にデインターカレーション(脱離)されるものです。よって反応が進むと負極表面付近の電解液中のLiイオン濃度が高くなってきます。すると電解液中にリチウムイオンを脱離するエネルギが上がるため、反応が進みにくくなります。
反応を進ませるにはLiを速く電極付近から遠くに拡散させる必要があります。そこで負極の電位が上がると、リチウムイオンにとっては負極側がより負安定になります。これにより電解液へリチウムイオンを脱離させやすくなり、電流を取り出しやすくなります。
以上のように、濃度過電圧は負極の反応電位を上げる方向にはたらきます。
濃度過電圧が電極の反応電位を上下させる方向は活性化過電圧のときと同じです。よって活性化過電圧の節で述べたように、過電圧があるときの端子電圧は正極と負極の過電圧分だけ小さくなります。
放電時における抵抗過電圧の影響
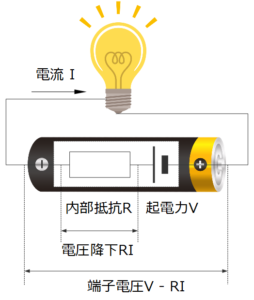
抵抗過電圧は端子電位を小さくする方向に働きます。
正極と負極の反応電位(および活性化過電圧、濃度過電圧)によって起電力 V が決まりますが、抵抗過電圧の原因となる終電体やリードの内部抵抗成分 R に電流 I が流れることで、電池の内部でRI (V)だけ電圧降下が起こります。これが抵抗過電圧です。したがって端子電圧は抵抗過電圧分だけ起電力より小さくなります。
放電時の過電圧
活性化過電圧、濃度過電圧、抵抗過電圧の3つの過電圧すべてが電圧を下げる方向にはたらきます。
充電時の端子電圧と起電力・過電圧の関係
放電のときと同様に正極にコバルト酸リチウム、負極に黒鉛を用いたリチウムイオン電池における充電反応を考えます。
充電時はコバルト酸リチウムからリチウムイオンがデインターカレーション(脱離)し、黒鉛にリチウムイオンがインターカレーション(挿入)反応が主として起こります。
反応式は以下の通りです。
正極:LiCoO2 → Li1-xCoO2 + xLi+ + xe–
負極:C6 + Li+ + e– → LiC6
充電時における活性化過電圧の影響
正極の反応で生成系のエネルギを下げるためには、正極の電位を上げる必要があります。
また負極の反応で生成系のエネルギを上げるには、負極の電位を下げる必要があります。
正極の電位が上がり、負極の電位が下がるので、充電時の端子電圧は活性化過電圧により大きくなります。
充電時における濃度過電圧の影響
正極の反応を進めるには、正極付近の電解液中のリチウムイオンを拡散させる必要があるので、正極の電位を上げればよいことになります。
負極の反応を進めるには、負極付近の電解液中にリチウムイオンを供給する必要があるので、負極の電位を下げればよいことになります。
正極の電位が上がり、負極の電位が下がるので、充電時の端子電圧は濃度過電圧により大きくなります。
充電時における抵抗過電圧の影響
充電時の端子電圧は充電反応を起こすために外部から印加する電圧に相当します。
上の図のように、実際は抵抗過電圧の原因となる内部抵抗が存在するため、内部抵抗による電圧降下(抵抗過電圧)分だけ大きな電圧を印可させる必要があります。
よって抵抗過電圧は、端子電圧を大きくする方向に働きます。







