リチウムイオン電池の充電・放電反応

こちらのページではリチウムイオン電池の充電および放電時でどんな反応が起こっているかとその意味をまとめています。
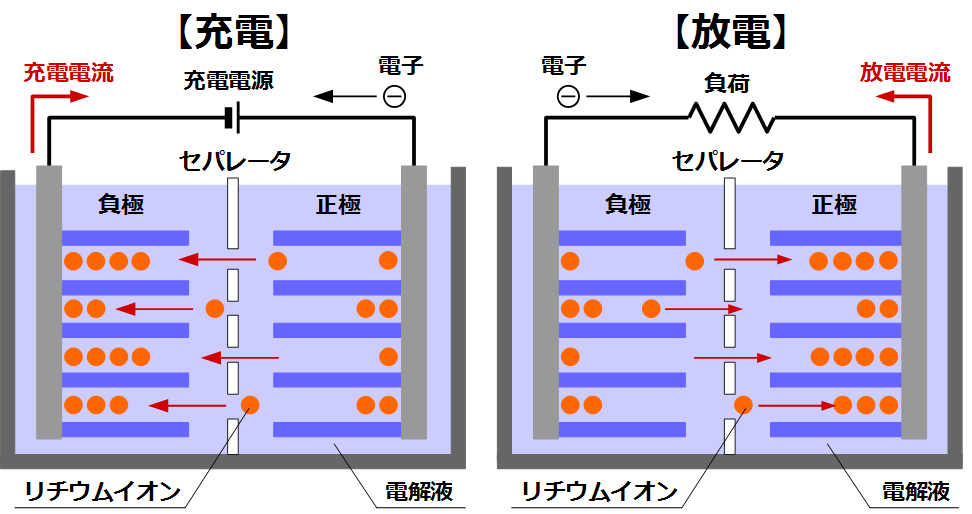
・充電時:正極が酸化反応、負極が還元反応、リチウムイオンは正極から負極へ移動
・放電時:負極が酸化反応、正極が還元反応、リチウムイオンは負極から正極へ移動
リチウムイオン電池の中で起こる反応
リチウムイオン電池は充電するときにどのようにして電気エネルギ(電力)をためているのでしょうか。
一言でいうと、リチウムイオン電池は外部から得た電気エネルギを電極材料の化学エネルギに変換することでエネルギをためています。
充電により化学エネルギがためられたときというのは、電極材料は不安定な状態 (エネルギが高い状態) になっています。このときに正極と負極の間に外部回路をつないで電気が流れるようにすると、正極と負極が電子をやり取りする反応(酸化還元反応)することにより電極材料は不安定な状態から安定な状態なります。これが放電反応です。
「電池は放電するとき正極から電流がでる。負極から電子が出る。」というのは中学校で習いますね。
放電時に負極が酸化反応して電子を出すのは、この習った電池のルールに一致しています。
電極の反応とリチウムイオンの動き
上記のような反応が起こるとき、リチウムイオンはどのような働きをしているのかについて考えてみます。
正極材料の場合、リチウムイオンが正極材料から抜け出した時にエネルギが高くなるように設計されています。また負極材料の場合、リチウムイオンが負極材料の中に入ってきたときにエネルギが高くなるように設計されています。
よって充電反応ではリチウムイオンが正極材料から出て、電池の中を通って、負極材料の中に入っていく反応が起こります。
では材料の中にリチウムイオンが入ったり出たりすると何が起こるのでしょうか?
リチウムイオンは1価のカチオン(陽イオン)ですので、例えばリチウムイオンが1つ抜けると元の電極材料は電子1個分マイナスに帯電します。これを補うように、電極材料が酸化反応を起こし電子を放出し電荷中性を保つようにします。ここで発生した電子が、外部回路を通って反対側の電極に流れ、還元反応を起こします。
まとめると充電するときと放電するときの反応は以下の通りです。
| 正極 | 負極 | リチウムイオン | 電子 | |
| 充電 | 酸化 | 還元 | 正極→負極 | 正極→負極 |
| 放電 | 還元 | 酸化 | 負極→正極 | 負極→正極 |
化学反応式で理解しよう
上で説明してきたことを化学反応式っぽく書くと以下のように書けます。
充電反応
正極:Liを含む正極 → Liが抜けた正極 + リチウムイオン + 電子
負極:Liが少ない(ない)負極 + リチウムイオン + 電子 → Liを多く含む負極
電池全体: Liを含む正極 + Liが少ない(ない)負極 → Liが抜けた正極 + Liを多く含む負極
電子が正極から負極に移動し、リチウムイオンも正極から負極に移動していることがわかります。
※ このとき電子は電池の外の(外部)回路を通って移動し、リチウムイオンは電池の内部を通って移動します
放電反応
正極:Liが抜けた正極 + リチウムイオン + 電子 → Liを含む正極
負極: Liを多く含む負極 → Liが少ない(ない)負極 + リチウムイオン + 電子
電池全体:Liが抜けた正極 + Liを多く含む負極 → Liを含む正極 + Liが少ない(ない)負極
電子が負極から正極に移動し、リチウムイオンも 負極から正極 に移動していることがわかります。
具体的な材料での反応例
以下では、もう少し具体的な反応例を見ることでイメージをつかみましょう。
正極がコバルト酸リチウム(LiCoO2)、負極が黒鉛(C)の場合の反応を考えてみます。コバルト酸リチウムは一昔前によく使用された正極材料です。容量が大きいという特徴がありますが、反応が進みすぎるとコントロールができなくなる”暴走”という現象が起きる課題があり、現在ではニッケルやマンガン酸化物もよく使用されています。
充電反応
正極:LiCoO2 → Li1-xCoO2 + xLi + xe–
負極:C6 +xLi+ xe– → LixC6
電池全体:LiCoO2 + C6 → Li1-xCoO2 + LixC6 (0<x<1)
正極では、コバルト酸リチウムからリチウムイオンが抜けることで酸化反応が起こっています。
コバルトCoの価数に着目してみると、式の左辺(反応前)Liが+1価、Oが-2価なので、LiCoO2が電気的中性であるためにはCoは3価であるはずです。式の右辺(反応後)では、例えばx=1の場合、CoO2になるので、 Oが-2価ということと電気的中性条件からCoは4価ということになります。つまりCoの価数が3価から4価と変化しており、Coの酸化が起こっていることがわかります。
負極は逆にCが還元反応をしています。
xが0<x<1の範囲になるのは、取り込むことができるLiの数がある範囲に限られるからです。
コバルト酸リチウムはCoO2で表されるコバルトと酸素で形成される8面体が連なった層と層の間にリチウムが挟まったような結晶構造であり、その層の間をリチウムが入ったり出たりします。8面体1つ、つまりCo1つにつきLiは1つしか入ることができませんので、x<1となります。
負極の黒鉛は炭素原子が作る6角形が面状に連なった層が重なった結晶構造を持っています。この炭素6個あたり1つのLiをためることができるので、C6個あたりLi1個という意味でLixC6 (0<x<1)となっています。
このリチウムをためることができる数が、電池の容量を決めています。
電池の容量については別の記事で紹介します。
放電反応
正極:Li1-xCoO2 + xLi + xe– → LiCoO2
負極:LixC6 → C6 +xLi+ xe–
電池全体: Li1-xCoO2 + LixC6 → LiCoO2 + C6 (0<x<1)
放電反応では逆に、正極が還元反応をしています。充電のときと同じように確認すると、Coの価数が4価から3価に変化しています。
負極は酸化反応をしています。





