リチウムイオン電池の過電圧

- 過電圧は、標準電極電位と、ある速度で反応が起こる電位との差分
- ある反応電流 i を決めた時に、過電圧 η が決まる
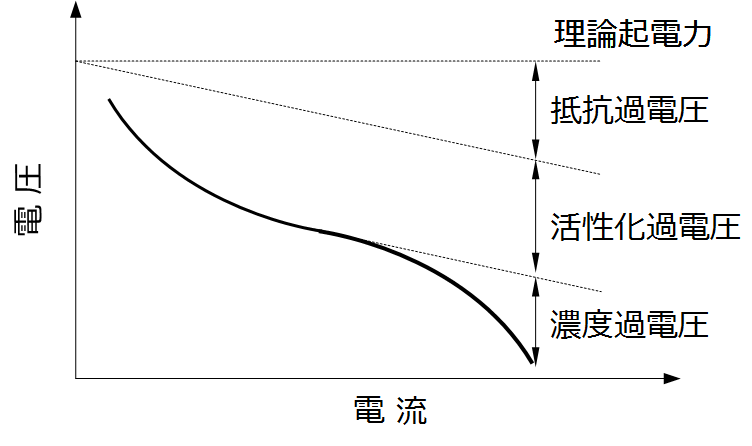
- 過電圧の主要因は、活性化過電圧、濃度過電圧、抵抗過電圧の3つ
過電圧の定義と意味
教科書*1 によると過電圧(overpotential)の説明として以下のように記載されています。
特定の電子授受反応に着目し、電流をある値に決めた時の分極を、その反応の過電圧という。
分極とは、ある反応の標準電極電位(平衡状態の電位)からの差のことです。
よって、過電圧は「その反応である電流iが流れるときの反応電位と標準電極電位との電位差」ということになります。
実験者側の視点でいうと、「ある化学反応によってある電流量を取り出そうとするときに、実験系に印可する必要がある(標準電極電位からの)電位差が過電圧である」といえます。
これの意味について少し補足します。電流は、その化学反応がどれだけ反応が起こったか(反応速度)ということの指標であり、電位はその反応を起こすための駆動力の指標です。よって、過電圧はその反応の駆動力と反応速度の関係性を示していると言えます。ちなみに。この関係式を表すのがターフェルの式です。
まとめると、過電圧は標準電極電位と、ある速度でその反応が起こる電位との差分のことです。
リチウムイオン電池の過電圧
ここではリチウムイオン電池における過電圧について説明します。
リチウムイオン電池の充放電のさせ方にはいくつか種類がありますが、最も主要な方法は一定の電流を流しながら反応を進める方法です。上で述べたように、過電圧はある一定の電流の反応が起こるときの電位と標準電極電位との差ですので、充放電電流をある値に決めた時に、反応が起こる電位が過電圧となります。放電させるときに過電圧は電池の電位を下げるように働きますので、リチウムイオン電池では電圧損失として性能に現れてきますので、過電圧は小さいほうが望ましいです。
リチウムイオン電池の端子電圧と過電圧の関係については 「リチウムイオン電池の端子電圧は電極電位と過電圧で決まる」の記事で詳しく説明していますので参考にしてみてください。
例えば、下の図はあるリチウムイオン電池の放電反応の反応電位について、放電電流を横軸にとったときのイメージ図です。右側の電流値が大きいときには起電力が低くなっている、つまり電圧の損失が発生していることになります。
過電圧は大きく分けて、活性化過電圧、濃度過電圧、抵抗過電圧の3つがあります。以下ではそれぞれについて詳しく説明します。
活性化過電圧
活性化過電圧は、電気化学反応を起こすための活性化エネルギを超えるために必要な過電圧です。”電荷移動抵抗”という言葉で説明されるときもあります。
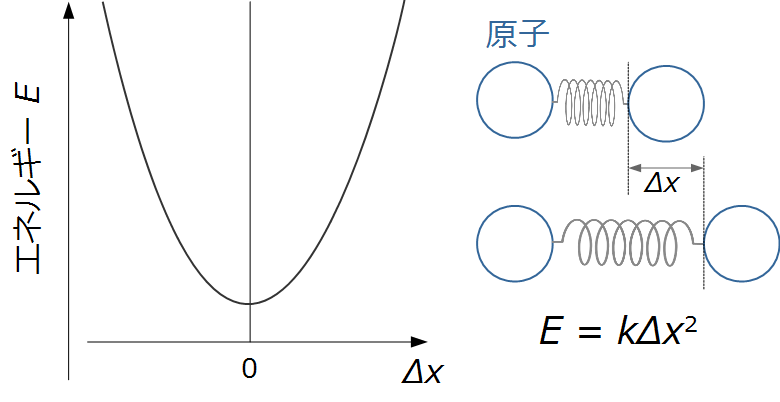
電気化学反応のイメージを下の図のように物質が離れていくように考えます。
安定な状態から物質が離れていくと不安定になります。
これをバネのようなイメージでとらえると、離れていった状態でのエネルギはフックの法則から
E = kΔx2
と書けますので、エネルギは放物線のようになります。
上の図は反応前の系(原系)のみのエネルギーですが、反応後の系(生成系)のエネルギも同様に放物線状になります。電気化学反応では、原系と生成系のエネルギ全体で考える必要があります。両方のエネルギを一緒に書いた図は下のようになります。
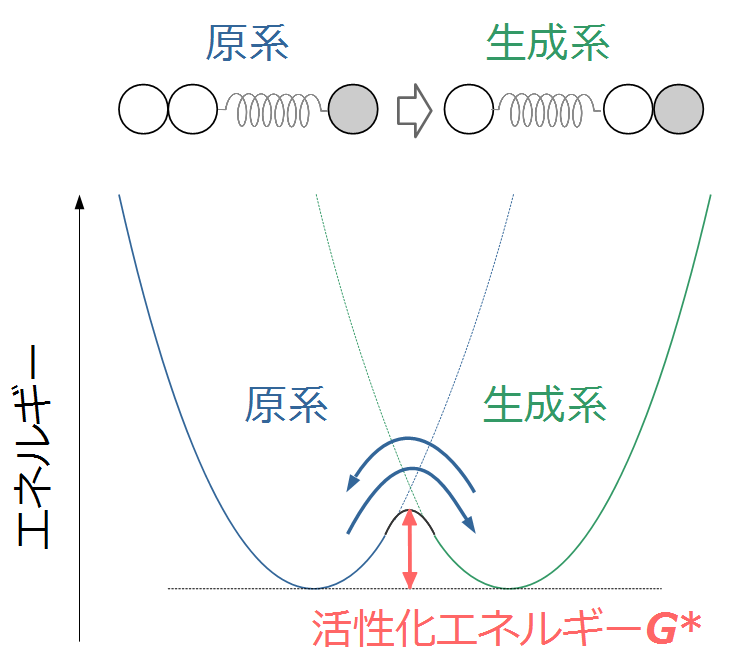
原系の状態から生成系の状態に進むには、ある障壁を超えなければなりません。このエネルギを活性化エネルギG*と呼びます。
活性化エネルギがG*のときの反応電流は、以下のように
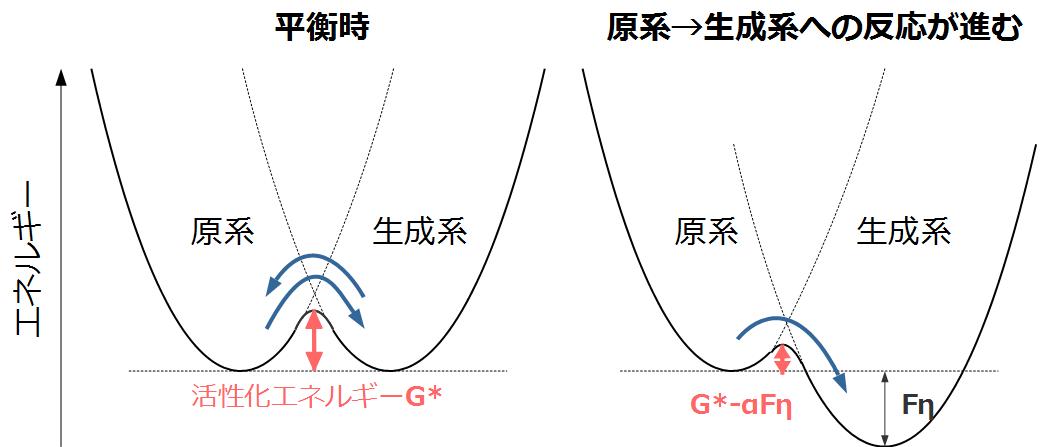
ここで書いた図は原系と生成系に進む反応と戻る反応が平衡状態のときのイメージ図です。右から左に行く場合と、左から右に進む場合の活性化エネルギが同じなので、両方の反応電流が等しく相殺している状態、つまり平衡状態となります。よってこのときの反応系の電位は標準電極電位ということになります。
よって式2の反応が右向きに進む、つまり右向きの反応電流の方が左向きの反応電流よりも大きくなるためには、右向きの反応の活性化エネルギが小さくなる必要があります。
右向きの反応は酸化反応です。この場合、正の方向に電位ηがかかると、生成系のエネルギが下がります。すると下の図のように右向きの活性化エネルギが左向きの活性化エネルギよりも小さくなるため、右向きの反応が進むようになります。さらに電位がかかっていない時よりも活性化エネルギは小さくなることがわかります。
逆に考えると、一定量の電流を取り出そうとすると、反応電位が標準電極電位からずれる必要があるということになります。これが活性化過電圧の正体です。
電流値が活性化エネルギによって決まるということから、電流を増やす(リチウムイオン電池でいえば高速充電する場合など)には活性化エネルギが小さくならなければなりません。よって大きな電流を取り出す場合、過電圧は大きくなります。
濃度過電圧
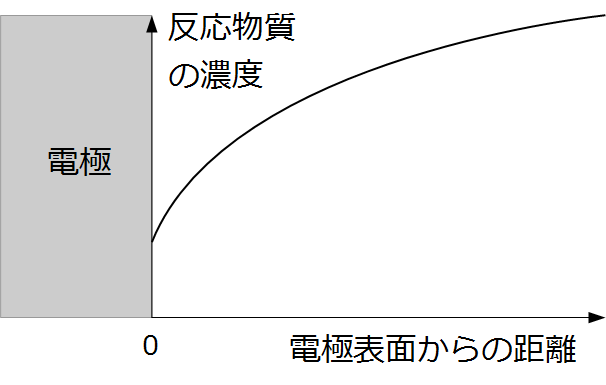
濃度過電圧は、電気化学反応の反応源物質の濃度が電極付近で低くなることで生じる過電圧です。「物質移動抵抗」という言葉で説明される場合もあります。
反応物は電極表面で消費されて、濃度が低くなります。
例えば、充電反応ならリチウムイオンが正極活物質の中にインターカレーションします。
すると正極表面での電解液の中のリチウムイオンの濃度が低くなります。すると、原系のエネルギが増えるため、活性化エネルギが増えます。この増分を濃度過電圧と呼びます。
次の反応が起こるためには正極表面にリチウムが拡散してこなければなりませんので、このような状態を物質移動律速もしくは拡散律速と呼びます。
上では電解液中のリチウムイオン濃度で考えましたが、リチウムイオンがインターカレーションする先である正極結晶の表面のリチウム濃度についても同じことが言えます。リチウムイオンがインターカレーションすると、リチウムイオンが入る席が埋まってしまうので、正極中でリチウムイオンが拡散しないと席が空かないので、さらなるインターカレーションが起こりにくい状態になります。このように正極内部の物質移動も濃度過電圧の原因となります。
抵抗過電圧
抵抗過電圧は、電極付近の抵抗成分に起因する過電圧です。
電池部材(終電体やリード)の抵抗による電圧ロスです。
オームの法則に従い、流す電流に比例する電圧になります。
抵抗過電圧の原因となる抵抗成分の大きさをRとし、そのとき流れる電流値をiとすると抵抗過電圧VRは
VR = i R
となります。
つまり、同じ電池でも急速充電や大電流の放電の場合に抵抗過電圧は大きくなることになります。
さいごに
この記事では過電圧についてご紹介しました。
過電圧は電池の性能を下げてしまう損失要因になりますので、その発生原因を理解しておくことは大切です。
参考文献
「電池がわかる 電気化学入門」渡辺正






