リチウムイオン電池の仕組み【基本をわかりやすく】

・電荷を持ったリチウムイオンがプラス極とマイナス極の間を行き来して充電&放電する
リチウムイオン電池とは
リチウムイオン電池は、充電することで繰り返し使うことができる電池の一種です。電池の内部でプラス極とマイナス極の間を、リチウムイオンが行ったり来たりして充電と放電を行うことにより、繰り返し使うことができます。
リチウムイオン電池を世界で初めて商品化したのは、ソニー・エナジー・テック社であり、同社が「リチウムイオン電池」をいう名前を付けました。
繰り返し使える電池を二次電池というため、リチウムイオン二次電池と呼ばれることもあります。
リチウムイオンとは
リチウムイオン電池と呼ばれるのは、リチウムイオンが動作に重要な役割を果たしているからです。
リチウムイオンはリチウム原子がイオンになったものです。元となるリチウム(元素記号はLi)は原子番号3の元素です。純粋なリチウムは白銀色をした軟らかい金属です。1つのリチウム原子から1つの電子が取り除かれたものがリチウムイオン(化学式はLi+)です。電子はマイナスの電荷をもっているので、リチウムイオンは電子1つ分プラスの電荷をもっていることになります。
リチウムイオンは液体や固体の中を動きやすい性質を持っています。上で、リチウムイオン電池は「 電池の内部でプラス極とマイナス極の間を、イオンが行ったり来たりして充電と放電を行う 」と書きましたが、多くのイオンは動きにくいので「行ったり来たり」させることは難しいです。しかし動きやすいリチウムイオンを使うことで電池として動かすことができるのです。
リチウムイオン電池の構造
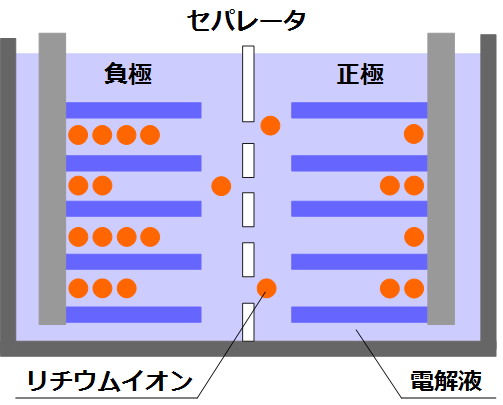
仕組みについて説明する前に、リチウムイオン電池の中に何が入っているかを説明します。
リチウムイオン電池は、一般的にプラス極(正極)・マイナス極(負極)・ 電解液・セパレータから構成されます。
上の図はリチウムイオン電池の概念図です。電解液の中にプラス極とマイナス極が、セパレータを挟んだ配置で浸されています。
リチウムイオン電池の構成部材
-
- プラス極 (正極):リチウムと金属を含む酸化物(セラミック)が使われます。代表的な例として、コバルト酸リチウム(LiCoO2)やニッケル酸リチウム(LiNiO2)、マンガン酸リチウム(LiMn2O4)などがあります。
- マイナス極 (負極):主に黒鉛(鉛筆の芯の仲間)が使われます。
- 電解液:有機溶媒(油の仲間)にリチウム化合物(LiPF6、LiBF4、LiClO4など)を溶かしたものが使われます。有機溶媒の例としては、エチレンカーボネート、プロピレンカーボネート、ジメチルカーボネートなどがあります。
- セパレータ:ポリオレフィンと呼ばれる高分子化合物からできた膜を使います。膜の表面には1マイクロメートル以下の小さな穴が開いています。ポリオレフィンの具体例としては、ポリエチレンやポリプロピレンなどがあります。
- 容器:金属ケースやラミネート材(アルミニウムやステンレスのような薄い金属を、ポリエチレンテレフタレートやポリプロピレンなどの樹脂でサンドイッチしたもの)が使われます。
※ 1マイクロメートルは1ミリメートルの1000分の1
リチウムイオン電池が充放電(充電と放電)する仕組み
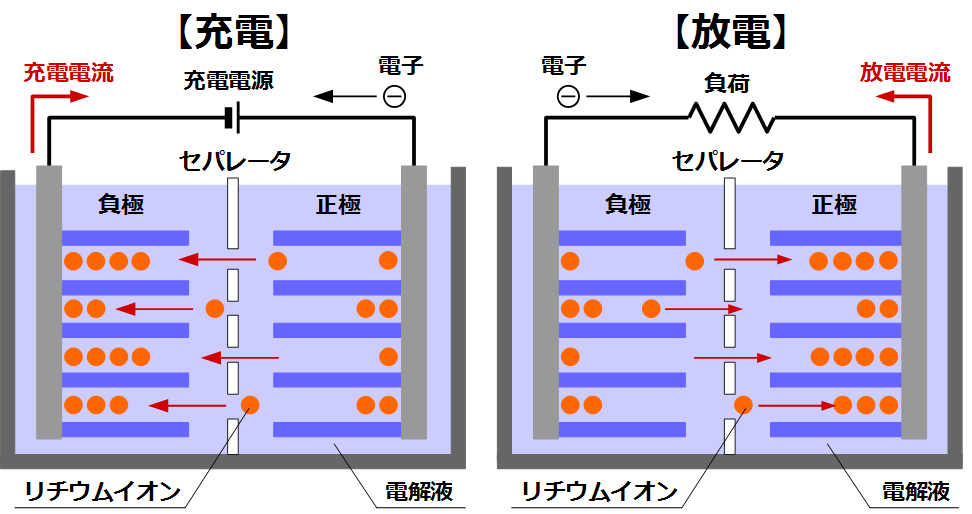
リチウムイオン電池が充放電(充電もしくは放電)するときには、リチウムイオンがプラス極とマイナス極の間をリチウムイオンが行き来します。
リチウムイオン電池に使われる多くのプラス極とマイナス極の材料は層状の構造になっており、層と層の間にリチウムイオンをためることができます。上で述べたように、リチウムイオンは電子1つ分プラスの電荷を持っているので、リチウムイオンを含んだマイナス極の材料からリチウムイオンが出ていくと、マイナス極はマイナスの電荷をもつことになります。このマイナスの電荷を電子として電池から取り出すことで、電力を得ることができます。これが放電反応(電池を使う反応)です。
逆に、外部から電気を流し込んでマイナス極の中に電子を取り込ませると、マイナス極材料がマイナスの電荷をもつことになります。このマイナスを打ち消すために、プラス極側からやってきたリチウムイオンがマイナス極に取り込まれます。これが充電反応(電池を使える状態にする反応)です。 マイナス極にリチウムイオンがたまっているので、上に述べた放電ができるようになります。
充放電において、プラス極はマイナス極から出て行ったリチウムイオンをため込んだり、マイナス極にため込むリチウムイオンの移動元となる働きをしています。
このようにして、リチウムイオンを動かして電気を溜めたり取り出したりする二次電池として動作しています。
充放電の際の電気化学的な反応については「リチウムイオン電池の充電・放電反応」の記事で詳しく紹介しています。






